Rheumatoide Arthritis
Was ist rheumatoide Arthritis?
Die rheumatoide Arthritis ist eine chronische, d. h. mehr als 6 Wochen anhaltende, meist an beiden Körperhälften gleichzeitig auftretende Gelenkentzündung (Arthritis = Gelenkentzündung). Früher wurde sie auch chronische Polyarthritis genannt (poly = viel), da die Entzündung im Verlauf mehr als 3 Gelenke gleichzeitig betrifft. Die Entzündung kann im Laufe der Zeit die Gelenke zerstören und ihre Beweglichkeit einschränken.
Schon wenige Wochen nach Beginn der Erkrankung lassen sich bei manchen Patienten mit modernen Untersuchungsmethoden (z. B. der Kernspintomografie) erste Gelenkveränderungen feststellen. Es wird empfohlen, mit der Behandlung möglichst innerhalb der ersten 3 Monate nach dem Ausbruch der Erkrankung zu beginnen, denn je früher mit der Therapie begonnen wird, desto geringer sind im weiteren Krankheitsverlauf die Schäden durch die Arthritis zu erleiden. Patienten mit typischen Krankheitszeichen sollten deshalb so früh wie möglich einen Facharzt für Innere Medizin und Rheumatologie (Rheumatologen) aufsuchen.
Die rheumatoide Arthritis ist die häufigste chronisch entzündlich-rheumatische Erkrankung überhaupt. Man schätzt, dass in Deutschland etwa 1% der Bevölkerung (etwa 800.000 Menschen) an rheumatoider Arthritis erkrankt ist. Frauen sind etwa 3-mal häufiger betroffen als Männer. Die rheumatoide Arthritis kann in jedem Lebensalter auftreten, Männer erkranken jedoch häufig zwischen dem 65. und 75 Lebensjahr, Frauen zwischen dem 55. und 64. Lebensjahr. Aber auch Kinder können an einer Form der rheumatoiden Arthritis erkranken (juvenile idiopathische Arthritis).
Ursachen & Risikofaktoren
Die rheumatoide Arthritis ist eine Autoimmunerkrankung, bei der das Immunsystem das körpereigene Gewebe angreift. Die eigentlichen Ursachen dieser Fehlsteuerung sind trotz intensiver Forschungen nicht bekannt. Es gibt eine genetische Veranlagung für eine rheumatoide Arthritis, z.B. tritt sie bei erbgleichen Zwillingen (eineiig) sowie in manchen Familien gehäuft auf.
Darüber hinaus gibt es wahrscheinlich weitere größtenteils nicht bekannte Faktoren, die den Ausbruch der Erkrankung auslösen oder begünstigen können. Rauchen scheint das Entstehen der Erkrankung stark zu begünstigen und verschlechtert nachweislich den Krankheitsverlauf.
Die Gelenke stehen bei der rheumatoiden Arthritis im Mittelpunkt des Entzündungsprozesses. Die Entzündung richtet sich gegen das körpereigene Gelenkgewebe, da das Immunsystem nicht mehr zwischen „Fremd" und „Eigen" unterscheiden kann. Der Körper bekämpft sich also selbst und zerstört so sein eigenes Gewebe.
Durch ein komplexes Zusammenspiel zwischen verschiedenen Entzündungszellen (Fresszellen, T- und B-Zellen) und entzündungsvermittelnden Eiweißmolekülen (die so genannten Zytokine) kommt es zunächst zu einer Schleimhautschwellung im entzündeten Gelenk. Die Gelenkschleimhaut beginnt zu wuchern und bildet knorpel- und knochenzerstörende Substanzen. Ohne eine entzündungshemmende Behandlung werden der Gelenkknorpel und der Knochen zerstört. Dadurch werden die Gelenke selbst funktionsuntüchtig.
Anzeichen & Symptome
Hauptmerkmal einer rheumatoiden Arthritis ist eine Entzündung der Gelenke. Sie bleibt jedoch oft nicht auf die Gelenke beschränkt, sondern kann sich auch auf andere Organe ausweiten.
Typische Merkmale von rheumatisch entzündeten Gelenken bei der rheumatoiden Arthritis sind:
- Gelenkschmerz, vor allem in Ruhe
- Morgensteife der Gelenke, die länger als 30 Minuten andauert
- Bewegungseinschränkung
- Schwellungen in mehr als 2 Gelenken
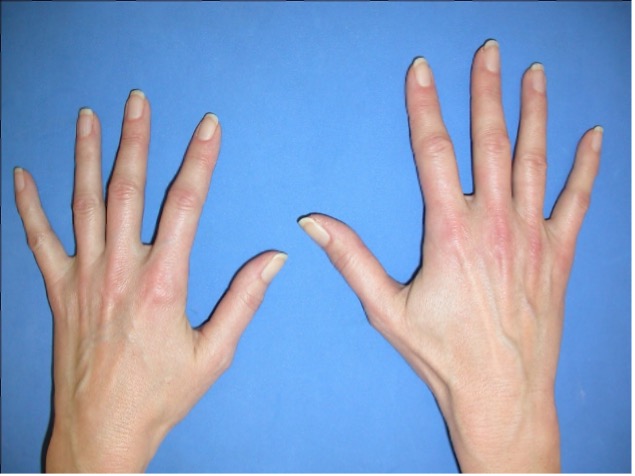
- Beidseitige Gelenkschwellung der Fingergrundgelenke und Fingermittelgelenke
- Gleiches Verteilungsmuster der betroffenen Gelenke auf der linken und rechten Körperseite
- im Langzeitverlauf knöcherne Deformierung
Symptome bei rheumatoider Arthritis
Die rheumatoide Arthritis verläuft sehr unterschiedlich: Sie kann schleichend an den kleinen Finger-, Hand- und Zehengelenken links und rechts beginnen. Sie kann aber auch abrupt auftreten und sie kann zu Beginn nur wenige, auch größere Gelenke einer Seite befallen, z. B. Knie, Schulter oder Ellenbogen. Meist befällt sie jedoch zuerst die Finger- und Handgelenke beidseits. Die Fingerendgelenke sind in der Regel ausgespart. Die Entzündung verursacht ein Anschwellen der Gelenkhaut. Die Gelenkschwellungen fühlen sich dadurch weich und prallelastisch an. Außerdem können sich die Beugesehnen und die Strecksehnen der Finger entzünden. Bei anderen Gelenken wie den Knie- und den Schultergelenken können die Schleimbeutel von der Entzündung mit betroffen sein.
Manchmal werden innerhalb von Wochen oder Monaten fast alle Gelenke befallen. In anderen Fällen scheint die Erkrankung jahrelang still zu stehen, bevor plötzlich schubweise weitere Gelenke dazu kommen: Zehen- und Fußgelenke, Ellenbogen, Schulter, Knie, Hüfte und die Halswirbelsäule. Abgesehen von der Halswirbelsäule befällt die rheumatoide Arthritis nicht die Wirbelsäule.
Die rheumatoide Arthritis führt zuerst zu einer Entkalkung des gelenknahen Knochens (Osteoporose). Im weiteren Verlauf zerstört sie den Knochen an den Ansatzstellen der Gelenkkapsel. Nach und nach wird der Gelenkknorpel ebenfalls abgebaut. Die fortschreitende Entzündung zerstört die Gelenkflächen und die Gelenkknochen weichen aus ihrer normalen Stellung. Eine Gelenkfehlstellung entsteht. Zusammen mit den Schmerzen schränkt diese Gelenkfehlstellung die Beweglichkeit des betroffenen und ggf. nachfolgender Gelenke ein. Die Patienten können dadurch oft einfache Handgriffe nicht mehr ausführen: das Öffnen einer Konservendose oder das Schnüren von Schnürsenkeln wird so zu einem unüberwindbaren Hindernis.
Bei fast der Hälfte der Patienten mit rheumatoider Arthritis befällt die Erkrankung andere Organe, wie z. B. Blutgefäße, Herz-/Kreislaufsystem, Lunge, Niere, Leber, Haut, Nervensystem oder
Drüsengewebe
Die rheumatoide Arthritis kann die Tränen- und Speicheldrüsen befallen und das Drüsengewebe zerstören. Dieser Verlauf wird auch Sicca-Syndrom bezeichnet und betrifft etwa ein Drittel der Patienten. Die Krankheitszeichen sind Mundtrockenheit und ein Mangel an Tränenflüssigkeit.
Blutgefäße
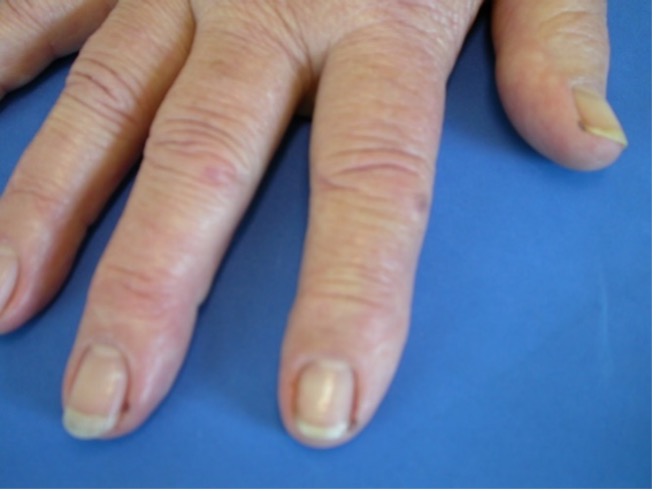
Entzündungen der Gefäßwände können sich in Durchblutungsstörungen äußern, die zu kleinen punktförmigen Wunden (siehe Abb. 2), zu Hautgeschwüren oder großflächigem Absterben von Gewebe führen können. Außerdem geht die rheumatoide Arthritis mit einer erhöhten Rate an Arterienverkalkung (Arteriosklerose) einher.
Herz
Patienten mit rheumatoider Arthritis haben ein erhöhtes Herzinfarktrisiko (koronare Herzkrankheit). Die Arteriosklerose der Herzkranzgefäße ist bedingt durch den entzündlich-rheumatischen Krankheits-Prozess, und tritt bei aktiver Gelenkentzündung, bei einer erhöhten Krankheitsaktivität häufiger auf. Neue Behandlungsmöglichkeiten, insbesondere mit den Biologika, gehen mit einer deutlich erniedrigten Rate an Erkrankungen durch Herzgefäße einher. Sie scheinen einen Schutzfaktor vor entsprechenden Herzerkrankungen darzustellen und senken die Sterberate an Herzinfarkten. Neben dem rheumatischen Entzündungsprozess, haben auch die Einnahme von nichtsteroidalen Antirheumatika und Kortison einen Anteil an der erhöhten Häufigkeit von Herzgefäß-Erkrankungen und Herzinfarkten bei der rheumatoiden Arthritis. Die Einnahme dieser Medikamente sollte daher auf das unbedingt notwendige Maß begrenzt bleiben.
Darüber hinaus kann eine rheumatoide Arthritis einen Herzklappenfehler und eine Entzündung des Herzmuskels sowie des Herzbeutels mit Herzbeutelerguss verursachen.
Lunge
Bei jedem 5. Patient mit rheumatoider Arthritis sind die Lungenbläschen entzündet. Die Entzündung führt zur unter Umständen zunehmenden Fibrose, Lungenverhärtung. In der Regel ist dies nur mit einer speziellen Untersuchungsmethode nachweisbar (mit hochauflösender Computertomografie, HR-CT der Lunge). Meistenteils ist, ohne dass eine entsprechende Symptomatik besteht, keine Behandlung erforderlich. In selteneren ausgeprägten Fällen mit Lungenfibrose = Lungenverhärtung sind Husten und Atemnot bei Belastung bis hin zu generellen Atmungsschwierigkeiten die Folge. Neue Medikamente, neue Therapieprinzipien sind seit dem Jahre 2020 für Patienten mit ausgeprägteren rheumatischen Lungenveränderungen zugelassen und können den Verlauf der Erkrankung deutlich abmildern.
Nervensystem
Werden im Handgelenk durch die Gelenk- und Sehnenentzündungen Nerven abgedrückt, kann dies Fehlempfindungen, Unempfindlichkeit und Schmerzen auslösen (Karpaltunnel-Syndrom).
Selten kann es im Rahmen der rheumatoiden Arthritis auch in Verbindung mit einer Gefäßentzündung zu Nervenschädigungen im Bereich der Füße, der Beine kommen, zu einer sogenannten Polyneuropathie. Diese Nervenschädigungen gehen mit Fehlempfindungen, Taubheitsgefühl und oft brennenden Schmerzen einher. Selten treten Lähmungserscheinungen auf.
Eine optimale Behandlung mit sehr niedriger Krankheitsaktivität oder Krankheitsstillstand kann einer rheumatischen Gefäßentzündung und damit einer distalen Polyneuropathie vorbeugen. Bei eingetretener Polyneuropathie kann eine starke Reduktion der rheumatischen Krankheitsaktivität den Krankheitsverlauf der Polyneuropathie abmildern oder auch zu einer Heilung führen.
Magen-/Darm-Trakt
Entzündungen, Blutungen und Geschwüre der Magen- und Darmschleimhaut sind häufig eine Folge einer Behandlung mit nichtsteroidalen Antirheumatika. Vor allem bei älteren Patienten, die zusätzlich mit Kortison behandelt werden und/oder bereits früher ein Magen- oder Darmgeschwür hatten, ist das Risiko für eine Schädigung der Magen-Darmwand deutlich erhöht.
In der Regel kann diese Magenschädigung durch nichtsteroidale Antirheumatica, durch eine Einnahme eines Magenschutzmittels, von sogenannten Protonenpumpen-Hemmern verhindert werden. Das Risiko für eine Magen- und Darmschädigung ist bei Einnahme einer Sondergruppe der nichtsteroidalen Antirheumatica, den sogenannten Cox-2-Hemmern oder Coxibe, geringer.
Untersuchungen & Diagnose
Früher wurde die Therapie der rheumatoiden Arthritis oft erst sehr spät begonnen. Heute weiß man, dass bei Patienten mit rheumatoider Arthritis die Gelenkzerstörung innerhalb der ersten 2 Jahre der Erkrankung am stärksten fortschreitet. Die Erfolgsaussichten einer Behandlung sind am größten, wenn in den ersten 3 Monaten nach Krankheitsbeginn mit einer wirksamen Behandlung, in der Regel einer sogenannten Basistherapie begonnen wird. In der DGRh-Leitlinie: Management der frühen rheumatoiden Arthritis, wird daher empfohlen bei Schwellungen und Schmerzen in mehr als 2 Gelenken spätestens nach 6 Wochen einen Rheumatologen aufzusuchen.
Als Faustregel gilt: Eine rheumatoide Arthritis liegt mit hoher Wahrscheinlichkeit vor, wenn
- Ein Patient mehr als 2 geschwollene Gelenke hat
- Eine symmetrische, weiche, häufig druckschmerzhafte Schwellung der Fingergrund- und Fingermittelgelenke vorliegt
- Die Fingergrundgelenke und die Zehengrundgelenke auf leichten Druck schmerzempfindlich reagieren
- Die Gelenke morgens länger als 30 Minuten steif bleiben (Morgensteifigkeit)
In der Regel fragen Patienten mit Gelenkerkrankungen zuerst ihren Hausarzt/Hausärztin um Rat. Für den behandelnden Arzt ist es besonders schwierig, eine rheumatoide Arthritis bereits kurz nach Krankheitsbeginn zu erkennen, da verschiedene Erkrankungen ähnliche Krankheitszeichen aufweisen und nicht selten die Erkrankung nicht vollumfänglich ausgeprägt ist. Es ist daher empfehlenswert bei V.a. eine entzündliche Rheumaform frühzeitig eine/n Rheumatologen/in aufzusuchen.
Um eine rheumatoide Arthritis von anderen Gelenkerkrankungen unterscheiden zu können, wird der Rheumatologe eine genaue Krankengeschichte (Anamnese) erheben, einen genauen Gelenkstatus erheben, auf Gelenkschwellungen untersuchen und Laboruntersuchungen sowie bildgebende Verfahren wie Sonographie und Kernspintomographie zur Diagnosestellung einsetzen. Dieses Mosaik oder Puzzle an Befunden richtig zusammenzusetzen, um die zutreffende rheumatologische Diagnose zu finden, liegt im zentralen Aufgabenbereich eines/r internistischen Rheumatologen/in.
Wichtige Informationen aus der Krankheitsgeschichte sind für den Arzt:
- Kommt oder kam bei anderen Familienmitgliedern eine rheumatoide Arthritis oder eine andere chronisch-entzündliche Rheumaform vor?
- Wann traten zum ersten Mal Gelenkschwellungen auf?
- Welche Gelenke sind betroffen? Wandert die Erkrankung von Gelenk zu Gelenk?
- Schreitet die Erkrankung schnell oder langsam voran?
- Treten die Gelenkschmerzen vor allem in Ruhe, nachts oder am frühen Morgen auf?
- Beeinflussen Wärme, Kälte, Bewegungen oder Belastungen die Schmerzen?
- Ändern sich die Schmerzen während des Tages (Besserung tagsüber oder besteht ein Dauerschmerz)?
- Gab es besondere Begleitumstände zu Beginn der Erkrankung, z. B. Infektionen, Durchfall, eine Augenentzündung oder andere Erkrankungen? Sind gleichzeitig andere Symptome aufgetreten (Kopfschmerz, Fieber, Abgeschlagenheit)?
Darüber hinaus muss der behandelnde Rheumatologe verschiedene Laboruntersuchungen vornehmen, um den Verdacht auf rheumatoide Arthritis erhärten zu können. Zusammen erlauben die Ergebnisse von Blutuntersuchungen und bildgebenden Verfahren (vor allem Sonographie, Kernspintomographie, Röntgen) eine sichere Diagnose bereits im Frühstadium der Erkrankung.
Laboruntersuchungen
Deuten Gelenkschwellung und Gelenkschmerzen auf eine rheumatoide Arthritis hin, kann der Arzt verschiedene Blutwerte des Patienten untersuchen, die ihm weitere Hinweise geben, ob eine Arthritis vorliegt. Jeder Blutwert ist für sich ist allerdings nicht sehr aussagekräftig, erst die Kombination aller Krankheitszeichen ermöglicht dem Arzt eine sichere Diagnose.
Erhöhte Werte für die so genannte Blutsenkungsgeschwindigkeit oder das Entzündungseiweiß C-reaktives Protein (CRP) deuten darauf hin, dass im Körper des Patienten eine Entzündung vorliegt. Ein erhöhtes CRP kann eine Hilfe bei der nicht immer einfachen Unterscheidung z.B. einer Arthrose der Fingergelenke von einer rheumatoiden Arthritis sein, die sich zusätzlich zur Arthrose entwickelt hat. Eine Arthrose (Verschleißerkrankung) verursacht zwar manchmal ähnliche Beschwerden, löst aber fast nie eine Entzündung im Blut aus. Dennoch sind erhöhte CRP-Werte nicht eindeutig auf eine entzündliche Rheumaform hinweisend, da auch andere entzündliche Erkrankungen die Blutsenkung erhöhen können. Normale CRP-Werte schließen eine rheumatoide Arthritis nicht aus. 10-30% der Patienten mit rheumatoider Arthritis weisen zu Beginn der Erkrankung keine erhöhten laborchemischen Entzündungswerte auf.
Ein weiterer wichtiger Blutwert ist der so genannte Rheumafaktor. Der Begriff Rheumafaktor ist irreführend, da nur 65-80% der Rheumapatienten auch tatsächlich diesen Faktor im Blut haben (seropositiv). Viele Patienten mit rheumatoider Arthritis weisen also keinen erhöhten Rheumafaktor auf, sie sind damit seronegativ. Außerdem kann der Rheumafaktor bei anderen chronisch-entzündlichen Rheumaformen wie z.B. dem Sjögren-Syndrom, dem systemischen Lupus erythematodes erhöht sein. Bei älteren Menschen oder Patienten mit anderen Erkrankungen kann der Rheumafaktor erhöht sein, obwohl sie keine rheumatoide Arthritis haben: 15% der älteren Bevölkerung und über 50% der Hepatitis-Patienten haben z.B. Rheumafaktoren im Blut, ohne dass eine rheumatoide Arthritis vorliegt.
Ein deutlich verlässlicherer Blutwert sind Antikörper gegen so genannte citrullinierte Peptide (z.B. anti-CCP Antikörper, anti-Vimentin Antikörper und anti-CEP1 Antikörper), sogenannte Anti Cytoplasmatische Antikörper (ACPA). Diese Eiweiße kommen ebenfalls bei 60-85% der Patienten mit rheumatoider Arthritis vor. Sie können selten vor dem eigentlichen Ausbruch der Erkrankung im Blut nachgewiesen werden. Im Gegensatz zum Rheumafaktor sind sie bei anderen Erkrankungen sehr selten erhöht. Ist ein Bluttest für diese Antikörper positiv, liegt mit sehr hoher Wahrscheinlichkeit (95%) eine rheumatoide Arthritis vor. Liegen ein positiver Rheumafaktor und pos. ACPA vor erhöht sich diese Wahrscheinlichkeit auf mehr als 98 %. Die Wahrscheinlichkeit des Vorliegens einer rheumatoiden Arthritis nimmt mit der Titer-Höhe der ACPA zu.
Erhöhte ACPA sind häufig mit einem schwereren oder besser, mit einem Verlauf verbunden, der einer intensiveren Behandlung bedarf, um einen Krankheitsstillstand zu erreichen. Die Wahrscheinlichkeit Knochenveränderungen bei der rheumatoiden Arthritis zu erleiden, ist höher bei positiven ACPA.
Rauchen und das Vorhandensein von ACPA begünstigt die Entwicklung einer rheumatoiden Arthritis.
Darüber hinaus kann der Rheumatologe weitere Blutwerte untersuchen, um zu entscheiden, ob eine rheumatoide Arthritis oder eine andere Erkrankung vorliegt:
Antinukleäre-Antikörper (ANA): Antikörper, die gegen die Zellkerne gerichtet sind. Sie sind bei etwa 10% der Patienten mit rheumatoider Arthritis nachweisbar. Bei Patienten mit Systemischem Lupus erythematodes sind ANA regelmäßig messbar. Anti-Desoxyribonukleinsäure-Antikörper (Anti-DNS Antikörper): weisen auf Systemischen Lupus erythematodes hin
Antineutrophile cytoplasmatische Antikörper (ANCA) und Antikörper gegen Proteinase 3 und Antikörper gegen Myeloperoxidase): Deuten auf spezielle rheumatische Erkrankungen der Blutgefäße (Vaskulitis) wie die Granulomatöse Polyangiitis (früher als Morbus Wegener beschrieben) oder die Mikroskopische Polyangiitis hin.
HLA-B27: Kann ein Hinweis auf eine entzündliche Wirbelsäulenerkrankung (axiale Spondyloarthritis, z. B. die Spondylitis ankylosans [früher Morbus Bechterew] oder eine sogenannte HLA-B 27 assoziierte Arthritis sein).
Erreger-Nachweis: Hat der behandelnde Arzt den Verdacht, dass die Gelenkentzündung durch Bakterien oder Viren ausgelöst wurde, kann er gezielt nach den Erregern suchen. In Frage kommen v.a. Blutuntersuchungen auf Borrelien (Lyme-Arthritis), Chlamydien, Yersinien, seltener Salmonellen oder Shigellen. Bei Frauen mit kleinen Kindern, die Ringelröteln hatten, sollte an eine Gelenkentzündung durch Ringelröteln gedacht werden und Antikörper gegen Parvo-Viren bestimmt werden
Erhöhte Harnsäure: bei einer deutlichen und schmerzhaften Gelenkschwellung mit lokaler Rötung vor allem eines Großzehengrundgelenks, aber seltener auch eines Sprung- oder Kniegelenks, sollte eine Gicht in Betracht gezogen, bzw. ausgeschlossen werden.
Bildgebende Verfahren
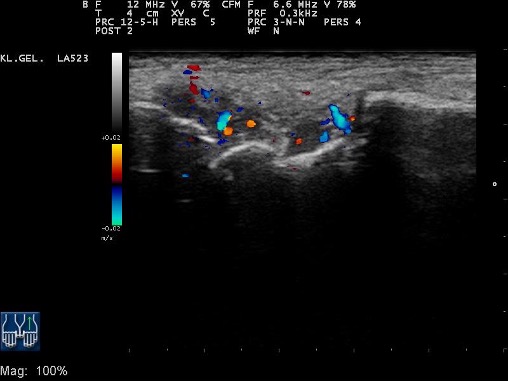
Verschiedene bildgebende Verfahren ermöglichen dem Rheumatologen darüber hinaus, den Zustand der Gelenke zu beurteilen. Eine wichtige Technik ist die Gelenkuntersuchung mit Ultraschall, die so genannte Gelenksonografie. Damit kann der Arzt Flüssigkeitsansammlungen in größeren Gelenken sowie Gelenkentzündungen in kleinen Gelenken erkennen, die von außen unter Umständen nicht sichtbar sind. Auch Rheuma-typische Knochenschäden und Gelenkzerstörungen (z. B. an den Finger- und Zehengelenken) kommen so zum Vorschein. Sehnenscheidenentzündungen und Sehneneinrisse können ebenso erkannt werden wie Schleimbeutelentzündungen oder auch Kalkablagerungen im Weichteilgewebe oder in den Gelenken. Über eine zusätzliche Untersuchung mit dem Powerdoppler kann eine erhöhte Durchblutung der Gelenkhaut erkannt werden, die auf eine verstärkte Entzündung und damit eine erhöhte Krankheitsaktivität hinweist. Mit dem Ultraschall in Verbindung mit dem Powerdoppler ist damit zusätzlich zur verbesserten Diagnostik einer rheumatoiden Arthritis, auch eine Aussage über die Aktivität der Erkrankung möglich (s. Abb. 3).
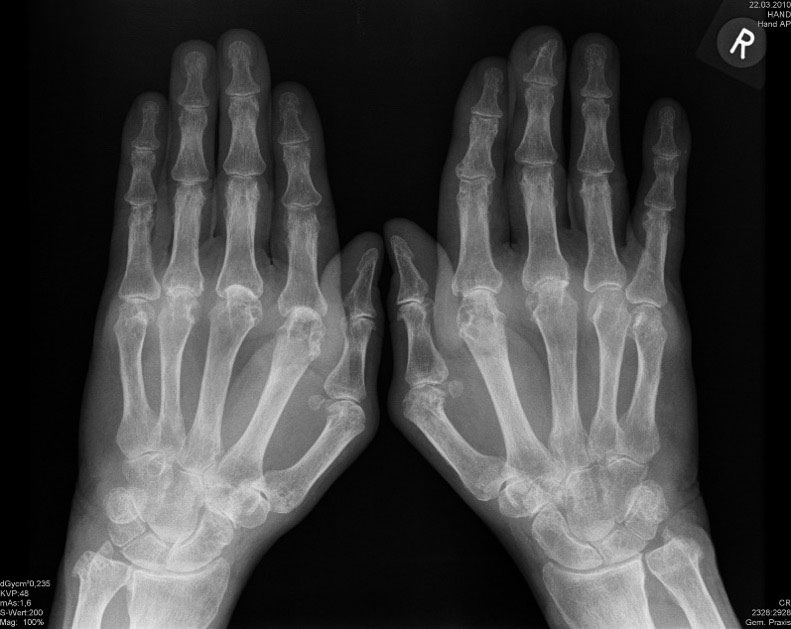
Röntgenaufnahmen von Händen und Füßen machen Gelenkzerstörungen sehr gut sichtbar: Entkalkung der Gelenkknochen können sehr früh im Krankheitsverlauf gefunden werden. Gelenkspaltverschmälerung und Knochenschädigungen können über das konventionelle Röntgen allerdings meistens erst in einem späteren Stadium einer rheumatoiden Arthritis gefunden werden (s. Abb. 4).
Eine frühzeitige, Leitlinien-gerechte und optimale Behandlung der rheumatoiden Arthritis verhindert allerdings die Entwicklung entsprechenden Knochenschädigungen: Die ersten im konventionellen Röntgenbild feststellbaren Veränderungen treten meist frühestens nach 12 Monaten Krankheitsdauer auf und sind dann nicht selten die Folge einer zu spät erfolgten Behandlung mit Basistherapeutika. Trotzdem gehören Röntgenaufnahmen zu den Untersuchungen, die geeignet sind, um den Verlauf der Erkrankung, um den Erfolg einer Behandlung mit Medikamenten zu kontrollieren. Allerdings ist eine Erfolgskontrolle mit Röntgen unter einer stabilen, erfolgreichen und sehr niedrigen Einstellung der Krankheitsaktivität mit Biologika und Janus-Kinase-Inhibitoren kaum noch sinnvoll, da sich hierunter nur noch sehr selten eine Zunahme an Rheuma-typischen Knochenveränderungen feststellen lässt.
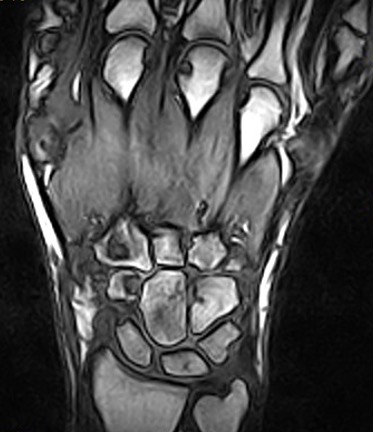
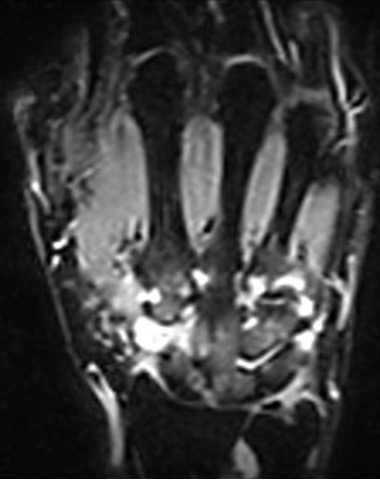
Eine Technik, die sich in den letzten eineinhalb Jahrzehnten gemeinsam mit dem Ultraschall zur Standardmethode für die Früherkennung der rheumatoiden Arthritis entwickelt hat, ist die Kernspin- oder Magnetresonanztomografie (MRT). Sie zeigt Veränderungen im Gelenk bereits im Frühstadium der Erkrankung (s. Abb. 5 und 6). Mit der Kernspintomografie können der Radiologe und Rheumatologe sowohl das Weichteilgewebe als auch den Knochen strahlenfrei und ohne Belastung für den Patienten sehr gut beurteilen. Knochenschädigungen lassen sich im MRT Monate bis Jahre bevor sie mit Röntgenaufnahmen sichtbar werden, erkennen. Das Ausmaß der Gelenkentzündung, von Sehnenscheidenentzündungen können ebenso wie Entzündungen im Knochen festgestellt werden. Diese Knochenentzündungen, die sich als Flüssigkeit im Knochen nachweisen lassen, zeigen einen potenziell knochenzerstörenden Verlauf der rheumatoiden Arthritis an. Bei Vorliegen von eindeutigen Knochenmarksentzündungen empfiehlt es sich daher umgehend mit einer Intensivierung der Behandlung, entweder über die medikamentöse Behandlung oder über Kortison-Injektionen in das betroffene Gelenk, zu reagieren. Knochenmarksödeme können ausschließlich über die Magnetresonanztomographie festgestellt werden. Rheuma-typische Knochenerosionen lassen sich vollständiger und detaillierter darstellen als über den Ultraschall. Insbesondere im Handgelenk können Erosionen durch die Gelenksonographie im Vergleich zur MRT nur unvollständig erfasst werden. In der Frühdiagnostik und auch in der Verlaufskontrolle der rheumatoiden Arthritis haben beide Methoden einen zunehmend wichtigen Stellenwert. Beide Untersuchungsmethoden helfen zum einen die Diagnose einer rheumatoiden Arthritis präzise zu stellen, und zum anderen im Verlauf der Erkrankung die Krankheitsaktivität zu überprüfen, einen erosiven, fortschreitenden Verlauf nicht zu übersehen und ggf. auf der Basis der bildgebenden Befunde (z.B. Vorliegen von Knochenmarksödemen im MRT eine richtige therapeutische Entscheidung zu treffen.
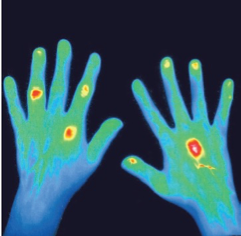
Eine wenig verbreite Technik ist die fluoreszenz-optische Darstellung der Hände mit dem RheumaScan (s. Abb. 7). Mit einem gut verträglichen Fluoreszenz-Mittel, das auch zur Darstellung des Augenhintergrundes Anwendung findet, können entzündete Gelenke, die eine Mehrdurchblutung aufweisen, optisch sehr eindrücklich dargestellt werden. Vergleiche mit der Sonographie und der Magnetresonanztomographie haben bezüglich der Entzündungsprozesse eine relativ gute Übereinstimmung gezeigt. Der RheumaScan wird üblicherweise für die Frühdiagnostik eingesetzt, und scheint eine sensitive Diagnostik der rheumatoiden Arthritis in Abgrenzung zu degenerativen Gelenkveränderungen der Hände zu ermöglichen. Ebenso scheint eine Differentialdiagnostik der Gelenkveränderungen bei der Psoriasisarthritis im Vergleich zur rheumatoiden Arthritis möglich zu sein. Eine klinisch oft schwere Abgrenzung eines milden Verlaufs einer seronegativen rheumatoiden Arthritis zu den Beschwerden bei der Fibromyalgie kann durch einen negativen RheumaScan-Befund ermöglicht werden. Andererseits kann eine sekundäre Fibromyalgie, die mit einer entzündlichen Rheumaform verbunden ist, über einen positiven RheumaScan-Befund demaskiert werden.
Die Knochenszintigrafie ermöglicht ein Screening des gesamten Körpers auf degenerative Prozesse und Entzündungen und Knochentumoren. Sie wird bei Patienten eingesetzt, bei denen die übrigen Untersuchungen kein klares Bild ergeben haben. Die Indikation zur Skelettszintigraphie begrenzt sich in der Rheumatologie mit den oben dargestellten bildgebenden Möglichkeiten auf seltene Ausnahmen. Die Knochenszintigraphie belastet den Patienten mit radioaktiver Strahlung und sollte deshalb nur unter strenger Abwägung des diagnostischen Nutzens eingesetzt werden.
Behandlung
Für eine wirksame Behandlung der rheumatoiden Arthritis ist es entscheidend, dass die Erkrankung so früh wie möglich erkannt und behandelt wird. Betroffene sollten deshalb bei verdächtigen Krankheitszeichen einen Rheumatologen aufsuchen. Die Behandlung der rheumatoiden Arthritis beruht auf 4 Säulen:
- Behandlung mit Medikamenten, um den Verlauf der Erkrankung zu verlangsamen oder aufzuhalten
- Physiotherapie, Ergotherapie und physikalische Maßnahmen, um die Beweglichkeit der Gelenke und die Funktionsfähigkeit der Gelenke in Beruf und Alltag zu sichern
- Eine Patientenschulung ist geeignet den Kenntnisstand über die Erkrankung verbessern, die Fähigkeit zu erlangen, positiv und kompetent mit der entzündlichen Gelenkerkrankung, mit den erforderlichen Medikamenten, mit den physikalischen Maßnahmen umzugehen, den Alltag besser zu bewältigen
- Operative Behandlung von Gelenken. Gelenkersatz, als letzter Ausweg, wenn ein Gelenk funktionsunfähig und stark schmerzhaft ist, Operation von Sehnenrupturen, Operation eines Karpaltunnel-Syndroms
Behandlung mit Medikamenten
Mit modernen Behandlungsmethoden kann ein Fortschreiten der Erkrankung deutlich verlangsamt oder sogar völlig zum Stillstand gebracht werden.
Entscheidend für den Behandlungserfolg ist ein früher Behandlungsbeginn: Um die Gelenkschäden möglichst gering zu halten, empfehlen wir Rheumatologen deshalb, die Behandlung mit krankheitsmodifizierenden Medikamenten (Basistherapien) so früh wie möglich, spätestens 3 Monate nach dem Ausbruch der Erkrankung zu beginnen. Bei den Rheumamedikamenten unterscheidet man zwischen 2 Gruppen von Medikamenten:
- Ausschließlich symptomatisch wirkende Medikamente, das sind die nichtsteroidalen Antirheumatika und Kortisonpräparate. Diese verringern zwar die Krankheitszeichen wie Schmerz und Gelenksteife, haben jedoch keinen Einfluss auf den Krankheitsverlauf. Kortison hat eine stark entzündungs-hemmende Wirkung und ist geeignet, dosisabhängig sehr rasch die Schmerzen und die Entzündung der Gelenke zu verringern.
- Krankheitsmodifizierende Medikamente, sogenannte Basistherapien, sind in der Behandlung der rheumatoiden Arthritis am wichtigsten. Sie verringern in unter schiedlichem Maße die übersteigerte Reaktion des Immunsystems und können so das Fortschreiten der Erkrankung verlangsamen oder stoppen. Der Stopp der knochenzerstörenden Wirkung der rheumatoiden Arthritis gelingt am besten unter Verwendung von sogenannten Biologika und den seit kurzem zugelassenen sogenannten JAK-Inhibitoren.
Symptomatische Behandlung
Nichtsteroidale Antirheumatika (NSAR), wie z. B. Ibuprofen oder Diclofenac, sind die am häufigsten zur Behandlung von Schmerzen eingesetzten Medikamente. Sie hemmen allerdings auch die Bildung von entzündungsfördernder Botenstoffe, so genannter Prostaglandine. Dadurch können sie die Entzündungs-prozesse an den Gelenken zwar verringern, aber bei weitem nicht aufhalten. Die Gelenkschädigung schreitet unter alleiniger Behandlung mit NSAR trotzdem fort.
Da Prostaglandine auch als Schutzfaktor für die Magen-Darmschleimhaut dienen, können die nichtsteroidalen Antirheumatika die Schleimhaut schädigen. Gefürchtete Nebenwirkungen von nichtsteroidalen Antirheumatika sind Magenschleimhautentzündungen (Gastritis) und Magen-/Darmgeschwüre (peptisches Ulkus). Deshalb sollten vor allem Patienten, die bereits eine Magen-/Darmentzündung oder ein Geschwür hatten, vorsorglich einen Magenschutz erhalten, wenn sie dauerhaft ein nichtsteroidales Antirheumatikum einnehmen. Als Magenschutz eignen sich Medikamente, die die Produktion der Magensäure hemmen, z. B. Protonenpumpenhemmer. Um die Gefahr von Nebenwirkungen möglichst gering zu halten, sollte die Dosis der nichtsteroidalen Antirheumatika so gering wie möglich gewählt werden. Außerdem sollten nie 2 verschiedene nichtsteroidale Antirheumatika gleichzeitig eingenommen werden.
Die so genannten COX-2-Hemmer oder Coxibe können eine Alternative für Patienten sein, die die traditionellen nichtsteroidalen Antirheumatika wegen der Nebenwirkungen am Magen-Darm-Trakt nicht vertragen oder die ein erhöhtes Risiko für diese Nebenwirkungen haben. Dies betrifft insbesondere Patienten ab dem 60. Lebensjahr, Patienten mit der Vorgeschichte von Magen-Darmgeschwüren und Patienten unter Kortison-Therapie. Einige Vertreter der Coxibe sind jedoch in Verruf geraten, da sie das Risiko für Herzinfarkte erhöhen können. Neuere Studien zeigten jedoch, dass das Risiko für Herz-/Kreislauferkrankungen bei Coxibe nicht höher ist als mit den traditionellen nichtsteroidalen Antirheumatika. Patienten mit einem erhöhten Risiko für Herz-/Kreislauferkrankungen sollten Coxibe und traditionelle nichtsteroidale Antirheumatika deshalb nicht einnehmen.
Traditionelle nichtsteroidale Antirheumatika und Coxibe können außerdem bei jahrelanger Anwendung und bei hohen Dosierungen die Nieren schädigen. Vor allem ältere Patienten mit vielen Begleiterkrankungen sind besonders gefährdet. Schmerzmittel, wie z. B. Metamizol oder Opioide, können dann eine Alternative sein.
Grundsätzlich gilt für traditionelle nichtsteroidale Antirheumatika und Coxibe, dass sie in der geringstmöglichen Dosierung und nicht länger als unbedingt notwendig eingenommen werden sollten, um das Risiko für Nebenwirkungen gering zu halten. Ob ein traditionelles nichtsteroidales Antirheumatikum oder ein Cox-2 Hemmer für einen Patienten mit rheumatoider Arthritis besser geeignet ist, hängt von den oben genannten Risikofaktoren und seinem persönlichen Risiko für Magen-/Darmerkrankungen ab.
Kortison (Steroide)
Kortison ist ein Hormon der Nebennierenrinde und wirkt entzündungshemmend. In mehreren Untersuchungen bei früher rheumatoider Arthritis konnte nachgewiesen werden, dass niedrig dosiertes Kortison zusammen mit Basismedikamenten (z.B. Methotrexat) eingenommen, besser vor Knochenzerstörungen durch Rheuma schützt als eine alleinige Behandlung mit Basismedikamenten. Die in der Langzeitbehandlung fast unvermeidlichen Nebenwirkungen, schränken die Kortisontherapie als Behandlungsoption jedoch auf eine möglichst kurzzeitige Therapie ein. Wenn möglich sollte Kortison nur bei aktiven Verläufen der frühen rheumatoiden Arthritis eingesetzt werden, bis die Basistherapie hinreichend wirkt. Bei weniger aktiven Krankheitsverläufen sollte nach Möglichkeit auf eine Kortisonbehandlung verzichtet werden.
Bei Krankheitsschüben kann Kortison in einer etwas höheren Dosierung (z.B. 15 bis 20mg Prednisolon/Tag) über einen kurzen Zeitraum von wenigen Tagen gegeben werden, damit die Schmerzen schnell zurückgehen und sich die Gelenkfunktion verbessert.
Über einen langen Zeitraum eingenommen, kann Kortison zu Knochenverlust (Osteoporose) führen. Es gibt bezüglich dieser Nebenwirkung nach bisheriger Kenntnis keine Schwellendosis von Kortison, d.h. eine Osteoporose kann auch bei niedriger Kortisondosis, die über einen längeren Zeitraum gegeben wird, auftreten. Patienten, die Kortison regelmäßig einnehmen, wird eine Knochendichtemessung mit DEXA (Dual Energy X-Ray Absortiometrie) regelmäßig empfohlen, um den Knochenschwund rechtzeitig zu erkennen und entsprechend vorbeugend behandeln zu können.
Bei langer Einnahme von Kortison oberhalb der sogenannten Cushing-Schwelle (in der Regel mehr als 7,5 bis 10 mg Prednisolon-Äquivalent) ist das Risiko von Infektionen (auch mit dem SARS-CoV-2 Virus) erhöht und eine Gewichtszunahme unvermeidlich. Des Weiteren treten gehäuft Herzinfarkte und Schlaganfälle unter Kortison auf. Wenn möglich sollte daher Kortison in der Langzeitbehandlung der rheumatoiden Arthritis gerade in Zeiten der Pandemie vermieden werden.
In der Akutbehandlung von sogenannten Rheumaschüben (Phasen mit hoher Krankheitsaktivität, ausgeprägten Gelenkschwellungen, starken Gelenkschmerzen) ist eine auf zwei bis drei Wochen befristet durchgeführte Kortisonstoss-Behandlung jedoch sehr hilfreich, risikoarm und in der Regel gut wirksam.
Basistherapie
Wir unterscheiden verschiedene Basistherapien:
- Sogenannte synthetische krankheitsmodifizierend wirkende Medikamente (sDMARD = synthetic disease modifying antirheumatic drug)
- Sogenannte Biologika, biologische krankheitsmodifizierend wirkende Medikamente (bDMARD = biologic disease modifying antirheumatic drug)
- Gezielt wirkende synthetische, krankheitsmodifizierend wirkende Medikamente (tsDMARD = targeted synthetic disease modifying antirheumatic drug), sogenannte Janus-Kinase-Inhibitoren oder JAK-Inhibitoren
Zu den oben genannten Basismedikamenten zählen alle Medikamente, die nicht nur die Schmerzen lindern, sondern krankheitsmodifizierende Eigenschaften besitzen und so die Gelenkzerstörung verzögern oder verhindern können. Ihre Wirkung setzt je nach Substanz mit unterschiedlich langer Verzögerungszeit ein (1 bis 2 Wochen, bis 6 Monate). Basismedikamente sind bei frühzeitigem Einsatz innerhalb der ersten drei Monate nach Krankheitsbeginn besser und nachhaltiger wirksam, als wenn diese Medikamente erst spät, d.h. mehr als 6-12 Monate, nach Beginn der Erkrankung eingesetzt werden. Werden die Basismedikamente in einer frühen Phase der rheumatoiden Arthritis eingesetzt, kommt die Erkrankung in bis zu 50% bis 80% der Fälle zum Stillstand. Nicht sehr selten kann nach einer erfolgreichen Behandlung mit Basismedikamenten die Krankheit auch ohne medikamentöse Behandlung für Monate oder Jahre inaktiv bleiben. Es besteht eine Chance, dass die rheumatoide Arthritis nach einer entsprechenden Behandlung auch ohne medikamentöse Behandlung inaktiv ist, dass ein länger gehender Krankheitsstillstand eintritt. Diese Chance ist bei frühzeitigem Beginn einer Behandlung mit Biologika und künftig vermutlich auch mit JAK-Inhibitoren größer als mit einer alleinigen Behandlung mit synthetischen Basistherapien.
Synthetische Basistherapien
Es sind dies in erster Linie Methotrexat, Sulfasalazin, und Leflunomid,
In den meisten Fällen empfiehlt der Rheumatologe zu Beginn einer Behandlung Methotrexat. Sollte dieses nach spätestens 3 Monaten nicht ausreichend wirken, kann er ein 2. Basismedikament mit Methotrexat kombinieren oder auch anstelle von Methotrexat ein anderes Basismedikament verschreiben. Dies kann bei einer aktiven Erkrankung mit einem früh knochenverändernden Verlauf, auch eine Basistherapie mit einem Biologikum oder mit eine JAK-Inhibitor sein. In der Regel werden Biologika und JAK-Inhibitoren zu Beginn der Behandlung mit Methotrexat kombiniert.
Bei allen synthetischen Basistherapien sollen regelmäßig Kontrollen des Blutbildes, der Nieren- und Leberwerte erfolgen. Die Basismedikamente können unter Umständen zu erhöhten Leberwerten, selten zu einer Knochenmarksschädigung mit einer Verminderung der roten und weißen Blutkörperchen, der Blutplättchen (Thrombozyten) sowie in seltenen Fällen zu einer eingeschränkten Nierenfunktion führen können, Durch diese Blutbildkontrollen kann in der Regel sehr zuverlässig vermieden werden, dass schwerwiegende Leber- Nieren- oder Knochenmarksschädigungen eintreten.
Das früher häufig eingesetzte Gold (als Tablette oder Spritze) und D-Penicillamin werden wegen ihrer Nebenwirkungen und der langsamen Wirkung (nach 3-6 Monaten) so gut wie nicht mehr verschrieben. Azathioprin und Cyclophosphamid spielen z. B. bei der Behandlung einer schweren begleitenden Gefäßentzündung oder einer Nierenfunktionseinschränkung, die den Einsatz anderer Basismedikamente ausschließt, noch eine Rolle. Cyclosporin A wird wegen der begrenzten Wirksamkeit und der nicht unerheblichen Nebenwirkungen nur noch selten in Ausnahmefällen als Basistherapie bei der rheumatoiden Arthritis eingesetzt.
Biologika-Behandlung
Für Patienten, die unzureichend auf die Therapie mit synthetischen Basismedikamenten ansprechen, steht seit etwa 20 Jahren eine neue Medikamentengruppe zur Verfügung. Diese sogenannten Biologika sind gentechnisch hergestellte Abwehrstoffe (z. B. Antikörper) die speziell gegen bestimmte Entzündungsbotenstoffe gerichtet sind oder bestimmte Rezeptoren und Immunzellen hemmen. Mit diesen Biologika begann zu Beginn dieses Jahrtausends eine neue Ära in der Behandlung der rheumatoiden Arthritis. Erstmals wurden bei der überwiegenden Mehrzahl der Patienten anhaltende Remissionen möglich, zum Teil sogar Medikamenten-freie Remissionen. Alle für die rheumatoide Arthritis zugelassene Biologika haben im Vergleich zu den synthetischen Basistherapien einen früheren Wirkeintritt. Meist nach 2 bis 4 Wochen ist eine Verringerung der entzündlichen Krankheitsaktivität für die Patienten spürbar. Alle Biologika können deutlich besser die Knochenzerstörung durch die rheumatoide Arthritis aufhalten als die älteren synthetischen Basistherapien. In der Regel ist unter einer Biologika-Behandlung nur noch ein minimales, oder kein Fortschreiten der Knochenveränderungen feststellbar. Dies ist überraschenderweise auch der Fall, wenn noch Gelenkschwellungen und Gelenkschmerzen bestehen, also kein diesbezüglicher Krankheitsstillstand vorliegt.
Zugelassene Biologika sind unter anderem Antikörper gegen den Tumornekrosefaktor Alpha (TNFα), sogenannte TNF-alpha Blocker. Es sind dies Adalumumab, Certolizumab, Etanercept, Golimumab und Infliximab. TNF-alpha ist ein wichtiger Botenstoff, der entzündliche Reaktionen des Körpers verstärkt. Allen TNF-Blockern ist eine ähnliche gute Wirksamkeit und ein fast ähnliches Nebenwirkungsprofil gemein. In der Regel werden die TNF-Blocker mit Methotrexat kombiniert, bzw. besteh nur eine Zulassung in Kombination mit Methotrexat (z.B. Golimumab/ Infliximab)
- Etanercept zeigt im Vergleich zu den anderen TNF-Blockern ein geringeres Risiko für die Aktivierung, den Ausbruch einer vorher nicht erkannten Tuberkulose. Durch ein Screening, durch eine entsprechende Untersuchung auf Tuberkulose (Tb) vor Beginn einer TNF-Blockerbehandlung ist allerdings dieses Risiko einer Aktivierung einer Tuberkulose auch für die anderen TNF-Blocker sehr gering geworden. Bei positivem Screening-Befund auf eine Tuberkulose (positiver Quantiferron oder Elispot-Tb-Test, und/oder ein Tuberkulosebefund in der Röntgenuntersuchung der Lunge), kann durch eine auf neun Monate befristete Einnahme von Antituberkulostatica (in der Regel Isoniazid) auch unter einer TNF-Blockade der Ausbruch einer Tuberkulose verhindert werden. Alle TNF-Blocker bedingen ein gering erhöhtes Risiko für schwere Infektionen. Allerdings ist dieses Risiko nicht höher als bei Patienten mit rheumatoider Arthritis mit hoher Krankheitsaktivität und ohne wirksame Basistherapie. TNF-Blocker werden entweder ins Unterhautfettgewebe injiziert (Adalimumab, Certolizumab, Etanercept, Golimumab) oder als Infusion verabreicht (Infliximab)
- Abatacept, ist ein Antikörper, der gegen T-Zellen gerichtet ist und über diesen Weg zu einer verringerten Ausschüttung von Zellbotenstoffen führt, die Entzündungen im Körper unterhalten, bzw. auslösen. Abatacept kann mit analoger Wirksamkeit entweder über wöchentliche Injektionen ins Unterhautfettgewebe verabreicht werden oder als Infusion in einer dem Körpergewicht angepassten Dosierung.
- Rituximab, ein Antikörper, der gegen B-Zellen gerichtet ist und mit dieser Wirkung zu einer monatelang anhaltenden Verringerung der Krankheitsaktivität führt. Rituximab wird als Infusion verabreicht, zu Beginn der Behandlung erfolgen zwei Infusionen in 14 tägigem Abstand, nachfolgend wird die nächste Infusion frühestens nach 6 Monaten verabreicht. Bisherige Studien zeigen gute Ergebnisse, wenn diese Infusionsbehandlung halbjährlich fortgeführt wird. Im Alltag kann es zielführender sein und ist letztlich mit weniger Nebenwirkungsrisiken behaftet, wenn die erneute Rituximab-Infusion erst dann erfolgt, wenn wieder erste Symptome einer Verschlechterung der Krankheitsaktivität eintreten. Nicht selten sind erneute Infusionen erst nach einem Dreivierteljahr oder auch deutlich später erforderlich. Vor Beginn der Rituximab-Infusion ist eine Vervollständigung des Impfstatus sehr wichtig, da zumindest im ersten halben Jahr nach einer Rituximab-Infusion, also in einem Zeitraum in dem bestimmte für die Immunabwehr wichtige B-Zellen nicht neu gebildet werden, der Körper nicht oder kaum auf eine Impfung mit Antikörperbildung anspricht. Grundsätzlich finden sich Infektionen unter Rituximab nicht häufiger als bei anderen Biologika. Die für die Infektabwehr wichtigen sogenannten Erinnerungs-Zellen werden durch Rituximab nicht angegriffen.
- Tocilizumab und Sarilumab sind Antikörper gegen Interleukin 6, einem entzündungsfördernden Botenstoff, der ebenfalls wie TNF-alpha für die Gelenkentzündung bei der rheumatoiden Arthritis verantwortlich ist. Tocilizumab kann in das Unterhautfettgewebe in wöchentlichem Abstand injiziert werden, Sarilumab alle 14 Tage. Tocilizumab steht zusätzlich als Infusion zur Verfügung, die alle 4 Wochen in einer vom Körpergewicht abhängigen Dosierung verabreicht wird. Das Nebenwirkungsprofil der Interleukin-6-Rezeptorantagonisten ist den TNF-Alpha-Blockern und Abatacept ähnlich. Für Tocilizumab, Sarilumab und Abatacept gilt allerdings, dass die Gefahr einer Tuberkulose bei vorbestandener und ausgeheilter TB-Infektion geringer ist als bei TNF-Blockern. Bei positivem TB-Screening-Befund muss allerdings auch unter diesen Medikamenten eine zeitlich befristete Behandlung mit einem Anti-Tuberkulostaticum erfolgen.
- Anakinra, ein Interleukin-1-Antikörper, der ebenfalls für die Indikation rheumatoide Arthritis zugelassen ist, spielt in der Versorgung der Patienten mit rheumatoider Arthritis keine Rolle mehr. Dies liegt an der geringen Wirksamkeit bei rheumatoider Arthritis, und der Notwendigkeit einer täglichen Injektion ins Unterhautfettgewebe.
Janus-Kinase-Inhibitoren
Aktuell Anfang des Jahres 2021 stehen 4 JAK-Inhibitoren zur Verfügung. In der Reihenfolge der Erstzulassung sind es die Janus Kinase-1 bis 3 Inhibitoren Tofacitinib und Baricitinib, sowie die JAK-1 Inhibitoren Upadacitinib und Filgotinib.
Januskinase-Inhibitoren hemmen auf zellulärer Ebene den Entzündungsstoffwechsel. Alle 4 Substanzen sind in Tablettenform erhältlich und werden täglich eingenommen. Sie entfalten auf die Botenstoffe TNF-Alpha und vor allem Interleukin 6, sowie auf weitere Entzündungsbotenstoffe, eine hemmende Wirkung. Es überrascht daher nicht, dass sie bei der Hemmung der Knochenzerstörung und auch auf die sonstige Gelenksymptomatik eine ähnlich gute Wirkung zeigen wie die Biologika und auch ein ähnliches Nebenwirkungsprofil aufweisen.
JAK-Inhibitoren zeigen auch ohne begleitende Methotrexat-Therapie eine sehr gute Wirksamkeit und können daher als Monotherapie eingesetzt werden. Die Behandlung mit JAK-Inhibitoren bietet sich daher insbesondere bei einer Methotrexat-Unverträglichkeit an. Eine analog gute Wirksamkeit bei einer Behandlung ohne begleitende synthetische Basistherapie mit z.B. Methotrexat, zeigen auch die Interleukin 6- Rezeptorantagonisten Tocilizumab und Sarilumab.
JAK-Inhibitoren zeigen nicht selten eine sehr schnelle Wirksamkeit auf den Entzündungsprozess der rheumatoiden Arthritis innerhalb von wenigen Tagen bis zu 2 Wochen.
Arzneimittelinteraktionen sind wegen der speziellen intrazellulären Wirkung der Januskinase-Inhibitoren stärker zu beachten als bei den Biologika.
Für Tofacitinib wurde ein erhöhtes Risiko für Thrombosen und Embolien beobachtet. Für die anderen JAK-Inhibitoren wird dieses Risiko diskutiert. Bei Patienten mit einer Thrombosevorgeschichte, oder Thromboseneigung sollte möglichst von einer JAK-Inhibitor-Behandlung abgesehen werden.
Unter JAK-Inhibitoren treten signifikant gehäuft Herpes Zoster Infektionen (Gürtelrose) auf. Seit mehr als einem Jahr ist eine Impfung gegen Herpes Zoster möglich. Über viele Monate war der Impfstoff leider in Deutschland nicht verfügbar. Seit Ende 2020 kann wieder mit Shingrix (dem Impfstoff gegen Herpes Zoster) geimpft werden.
Allgemeines zur DMARD-Therapie
Für alle oben genannten Basistherapien gilt, dass vorab eine Impfung gegen Pneumokokken, und grundsätzlich eine Grippeschutzimpfung empfohlen wird. Wegen des gehäuften Auftretens eines Herpes Zoster unter JAK-Inhibitor-Behandlung (s.o.), sollte vor Beginn dieser Behandlung eine Impfung gegen Herpes Zoster erfolgen.
Bisher gibt es trotz der immunsupprimierenden Wirkung der Biologika und der gezielt wirkenden synthetischen Basistherapien aus den Zulassungsstudien und den nachfolgenden weltweiten Verlaufsbeobachtungen (Register) keinen Hinweis auf eine erhöhte Krebshäufigkeit unter diesen Medikamenten. Allerdings sind die Lymphomraten unter TNF-Blockern höher als in der Normalbevölkerung, jedoch nicht höher als bei Patienten mit aktiver rheumatoider Arthritis ohne TNF-Blocker.
Für TNF-Blocker und Rituximab wurde in ersten Registerergebnissen eine höhere Lebenserwartung festgestellt als bei Patienten mit rheumatoider Arthritis, die nur mit den bisherigen synthetischen Basistherapien behandelt wurden. Insgesamt ist dies in Verbindung mit der guten Wirkung auf die Krankheitsaktivität, die Knochenzerstörung, eine gute Botschaft für die Anwendung der Biologika.
Bei Patienten mit rheumatoider Arthritis können die Biologika vor allem in Kombination mit dem Basismedikament Methotrexat die Schädigung der Gelenke schneller und wirkungsvoller aufhalten als das Methotrexat allein. Sie werden entsprechend der in Deutschland bestehenden Therapieempfehlungen bei Patienten mit rheumatoider Arthritis eingesetzt, bei denen eine alleinige Therapie mit 2 verschiedenen Basis-medikamenten über 6 Monate hinweg nicht genügend gewirkt hat oder die diese nicht vertragen haben. Bei stark fortschreitendem Verlauf der rheumatoiden Arthritis mit Gelenkzerstörungen unter dem zuerst eingesetzten Basismedikament, können TNF-alpha-Blocker entsprechend der Therapieempfehlungen der Deutschen Gesellschaft für Rheumatologie bereits als zweites Basismedikament eingesetzt werden.
Wer soll die Basistherapien durchführen?
In den deutschen und europäischen Leitlinien besteht Einigkeit, dass die Behandlungseinleitung und -kontrolle der vielfältigen Basistherapien in den Aufgabenbereich des Rheumatologen mit internistischer Weiterbildung fällt.
Welches Basistherapeutikum soll zu welchem Zeitpunkt verordnet werden?
Welche Basistherapien in welcher Reihenfolge am besten bei welchen Patienten gegeben werden sollen, wird weitgehend analog in einer deutschen und einer europäischen Leitlinie vorgeschlagen und wird in den Leitlinien in Abständen an neue Erkenntnisse und neue Medikamentenzulassungen angepasst.
Wie lange sollen Basistherapien durchgeführt werden?
Grundsätzlich ist die rheumatoide Arthritis, eine chronische, lebenslang anhaltende Erkrankung. Neuere Beobachtungen zeigen jedoch, dass je früher mit einer wirksamen Basistherapie begonnen wird, umso höher ist die Chance auf einen Krankheitsstillstand. Insbesondere unter frühzeitiger Biologika-Therapie scheint dieser Krankheitsstillstand bei einer Behandlung, die kurz nach Beginn der Erkrankung begonnen wird, häufiger einzutreten. Besteht dieser Krankheitsstillstand unter Biologika- oder ggf. auch unter synthetischer Basistherapie über mehr als 6 Monate, zeigen mehrere Studien, dass eine Verringerung und seltener ein Absetzen der Medikation möglich ist, ohne dass zumindest die Mehrzahl der Patienten eine Krankheitsverschlechterung zeigen.
Alle diesbezüglichen Untersuchungen zur Medikamentenverringerung bei Krankheitsstillstand haben die Einschränkung, dass nur eine kleine Zahl an Patienten und nicht alle Biologika, Basistherapien entsprechend untersucht wurden. Dennoch weisen die Ergebnisse auf die sinnvolle Möglichkeit einer Medikamentenreduktion bei stabiler Remission hin. Auch ein komplettes Absetzen ist möglich, allerdings ist die Rate an Krankheitsrezidiven, an einem Wiederaufflammen der rheumatoiden Arthritis höher als bei vorsichtiger Medikamentenreduktion. Ein rasches Wiederansetzen der bisher wirksamen Basistherapie ist bei Wiederaufflammen der rheumatoiden Arthritis nach Dosisverminderung oder Absetzen erforderlich und so zeigen es bisherige Ergebnisse, auch in der Regel rasch schnell wirksam.
Im Rahmen eines vom Innovationsfond geförderten bundesweiten Projektes (VERhO) an dem auch unser Rheumazentrum teilnimmt, soll der Frage nach dem Erfolg und dem besten Vorgehen bei einer Medikamentenreduktion unter stabiler Remission, bei mehr als tausend Patienten nachgegangen werden.
Es ergibt sich damit die sehr positive Perspektive einer Erkrankung, die mit einer frühzeitigen Basistherapie und den neuen Behandlungsmöglichkeiten (Biologika, gezielte synthetische Basistherapien) zusehends erfolgreicher behandelt werden kann und bei der ein Krankheitsstillstand ein erreichbares Ziel ist. Ein Krankheitsstillstand, der nicht zwingend mit einer Fortführung der bisherigen immunsupprimierenden Medikation verbunden ist, sondern eine Verringerung und deutlich seltener sogar ein Absetzen der Medikation erlaubt. Ein Absetzen, das allerdings nach Monaten oder Jahren von einem erneuten Aufflammen der Erkrankung gefolgt sein kann.
Andere Therapieformen
Eine sehr wichtige aber letztlich nur unterstützende und befristet wirksame Behandlungsmethode ist, Kortison direkt in die entzündlich betroffenen Gelenke zu spritzen, wenn die Basistherapie in einzelnen Gelenken nicht ausreichend wirksam ist und eine erhebliche Gelenkschwellung oder ein Erguss trotz einer ansonsten wirksamen Basistherapie besteht. Eine Gelenkpunktion mit nachfolgender Injektion eines an Kristalle gebundenen, sehr lange, in der Regel 6 Wochen, lokal wirksamen Kortisons kann die Gelenkschwellung und den Gelenkschmerz deutlich und nicht selten dauerhaft verringern.
Eine ungünstige Wirkung des in das Gelenk injizierten Kortisons auf den gesamten Körper, ist nicht zu befürchten, da das Kortison durch die Bindung an die Kristalle kaum in den Blutkreislauf übertritt. In seltenen Fällen treten vorübergehende Überempfindlichkeitsreaktionen nach einer Kortison-Injektion auf: Ein Hitzegefühl und ein roter Kopf dauern höchstens 1-2 Tage an und sind harmlos. Eine Reizung der Gelenkhaut durch die eingespritzten Kristalle kann allerdings sehr schmerzhaft sein und eine nochmalige Injektion mit einem Betäubungsmittel erforderlich machen. Auch bakterielle Infektionen werden nach einer Injektion in ein Gelenk sehr selten (in 1 von 13.000 Fällen) beobachtet und können und sollten durch steriles Arbeiten vermieden werden. Wegen der erforderlichen speziellen Erfahrung mit der Gelenkpunktionstechnik sollten diese Kortison-Injektionen in ein Gelenk nur von Rheumatologen oder Orthopäden durchgeführt werden.
Außerdem kann die entzündete Gelenkschleimhaut insbesondere des Kniegelenkes in einer Operation (Gelenkspiegelung) entfernt oder mittels radioaktiv markierter Substanzen (Radiosynoviorthese) verödet werden. Als alleinige Behandlungsmethode für eine Gelenkschleimhautentzündung des Kniegelenkes oder anderer Gelenke hat allerdings die operative Entfernung der Gelenkhaut wegen der hohen Rückfallrate keinen Stellenwert. Sie sollte für sehr seltene behandlungsresistente Fälle, die auf eine medikamentöse, basistherapeutische Behandlung nicht ansprechen, reserviert bleiben.
Die Radiosynoviorthese kann insbesondere am Kniegelenk eine wirksame Methode sein, um Entzündungen der Gelenkhaut zu behandeln, zu vermindern, die nicht auf vorausgegangene, vielfältige medikamentöse Behandlungsversuche mit Basistherapien und auch nicht auf Gelenkinjektionen mit Kortikosteroiden ansprachen.
Eine Operation kann notwendig werden, um eine Fehlstellung des Gelenks zu korrigieren und die Druckbelastung zu verlagern. Sind mittlere und große Gelenke durch die rheumatische Erkrankung hochgradig zerstört, ist ein künstlicher Gelenkersatz (Endoprothese) oder eine operative Versteifung der letzte Ausweg.
Patientenschulung
Wir bieten in unserem Rheumazentrum in Bad Aibling und Erding seit dem Jahre 2015 eine Patientenschulung für Patienten mit rheumatoider Arthritis an. Diese Schulung wurde von der Deutschen Gesellschaft für Rheumatologie, dem Berufsverband Deutscher Rheumatologen und der Deutschen Rheumaliga unter dem Akronym STRUPI-RA (Strukturierte Patienteninformation für Patienten mit rheumatoider Arthritis) konzipiert.
Die Patientenschulung umfasst 3 Module zu jeweils 2x 45 min mit den Inhalten:
Diagnose der rheumatoiden Arthritis; Therapie der rheumatoiden Arthritis; Alltagsbewältigung
Die Schulung wird von gesondert weitergebildeten Rheumatologischen Fachassistentinnen durchgeführt und von uns Rheumatologen begleitet. Während und nach der Patientenschulung stehen wir für Fragen bereit. Um genügend Gelegenheit für einen intensiven Austausch zu geben, sollten nicht mehr als 9 Patienten an der Schulung teilnehmen. Zur Nachbereitung der Schulung stellen wir Informationsmaterial zur Verfügung.
Die Patientenschulung dient dem besseren Verständnis der Erkrankung, der verwendeten Medikamente und der bestehenden sonstigen Behandlungsmöglichkeiten. Vorschläge zur besseren Bewältigung des Alltags werden gemeinsam diskutiert. Das Ziel der Schulung ist unseren Patienten den Umgang mit der Erkrankung, mit den Medikamenten zu erleichtern, Vertrauen aufzubauen und die Eigenkompetenz in allen Fragen zur Erkrankung zu verbessern.
Die Patientenschulung wird im Rahmen von Selektivverträgen von den Krankenkassen TK, Pronova, BKK Mobil Oil und Barmer GEK sowie von den Privatkrankenkassen erstattet. Falls Patienten anderer Krankenkassen an der Patientenschulung teilnehmen möchten, wird eine Gebühr von 25 € pro Modul in Rechnung gestellt. Eine Kostenübernahme kann bei der jeweiligen gesetzlichen Krankenkasse beantragt werden.
Physikalische Maßnahmen und Physiotherapie
Parallel zur Behandlung mit Medikamenten sollten Patienten mit rheumatoider Arthritis mit Hilfe von physiotherapeutischen Maßnahmen versuchen, die Beweglichkeit ihrer Gelenke zu erhalten oder wieder her- zustellen. Außerdem soll die gelenkstützende Muskulatur gestärkt werden. Zu den wichtigsten Maßnahmen gehören:
- Eine sachgerecht durchgeführte Krankengymnastik kann die Beweglichkeit der Gelenke verbessern, Fehlstellungen verringern und die Gelenke stabilisieren.
- Selbständige Bewegungsübungen nach vorausgegangener krankengymnastischer Anleitung
- Bewegungsbäder unter krankengymnastischer Anleitung
Während akuter Entzündungsschübe sollten die physiotherapeutischen Maßnahmen jedoch vorsichtig durchgeführt werden oder ganz unterbleiben. Eine zu starke Beanspruchung des Gelenks kann die Entzündung weiter verschlimmern.
Orthopädische Hilfsmittel, wie z. B. Schienen, Orthesen und funktionelle Verbände, können helfen, bei schmerzhaften Gelenkfehlstellungen die Gelenkfunktion für den Alltagsgebrauch aufrechtzuerhalten.
Die verschiedenen Wärmebehandlungen wie Fango, Moor und heiße Bäder können entzündete Gelenke ebenfalls belasten und sollten deshalb vorsichtig bzw. bei bestehender entzündlicher Aktivität der rheumatoiden Arthritis am besten überhaupt nicht eingesetzt werden.
Eine Kältebehandlung, z. B. mit Kryopackungen, wirkt bei ausgeprägt rheumatisch entzündeten Gelenken in der Regel gut. Die Behandlung in der Kältekammer hat eine vorübergehende schmerzlindernde Wirkung.
Milde Wärmebehandlungen (z.B. Kirschkernkissen oder Rotlicht) empfinden Patienten nicht selten auch bei leichtgradig rheumatisch entzündeten Gelenken als angenehm und verbessern die Beweglichkeit.
Ein Saunabesuch hat in der Regel keinen nachteiligen Effekt auf den Entzündungsprozess.
In einer Beschäftigungstherapie (Ergotherapie) können Patienten mit rheumatoider Arthritis erlernen, wie alltägliche Verrichtungen gelenkschonend durchgeführt werden. Sie üben dort auch den Umgang mit gelenkschonenden Hilfsmitteln, die Gelenkfehlstellungen vorbeugen. Diese Hilfsmittel sind meist an die Bedürfnisse der Patienten angepasste Gebrauchsgegenstände, die das Leben zuhause erleichtern können.
Weitere physikalische Behandlungen, die bei entzündlichen Gelenkerkrankungen durchgeführt werden können, sind:
- Hochfrequenztherapie
- Mittel- und Niederfrequenzstrom
- Ultraschall
- Infrarotbestrahlung
Eine günstige Wirksamkeit dieser Verfahren auf die Schmerzsymptomatik, auf die Gelenkschwellungen und den Verlauf einer entzündlich-rheumatischen Gelenkerkrankung ist nicht belegt.
Nahrungsmittelergänzung und alternative Medizin
Es gibt eine Vielzahl frei verkäuflicher Nahrungsergänzungsmittel und alternativer Heilmethoden, die Patienten mit rheumatoider Arthritis Linderung ihrer Leiden versprechen. Die Wirksamkeit dieser Angebote ist selten zweifelsfrei bewiesen. Außerdem sind sie nicht selten teuer und die Kosten werden von den Krankenkassen nicht übernommen.
Grundsätzlich sollten Patienten mit rheumatoider Arthritis Nahrungsmittel bevorzugen, die entzündungshemmende Substanzen enthalten.
Dazu gehören:
- Fischöl
- Soja-, Weizen- und Rapsöl
- Nachtkerzenöl
- Samen der schwarzen Johannisbeere
Entzündungshemmende Bestandteile sind die Eicosapentaensäure, Alpha-1-Linolensäure oder die Gamma-Linolensäure. Sie scheinen die Auswirkungen der rheumatoiden Arthritis auf die Gelenke zu verringern.
Fleisch und fettreiche Milchprodukte enthalten dagegen entzündungsfördernde Inhaltsstoffe, die Arachidonsäure, und sollten deshalb gemieden werden.
Die Wirksamkeit von Selen und Zink, sowie von Anti-Oxidantien, wie z. B. Vitamin E, die aggressive Sauerstoffradikale binden, ist ebenfalls nicht erwiesen.
Auch zum Nutzen von Homöopathie und Akupunktur gibt es nur wenige aussagekräftige Untersuchungen. Es gibt keinen Hinweis, dass sie eine dauerhafte Besserung bei rheumatoider Arthritis bewirken können.
Patienten mit rheumatoider Arthritis sollten auf ein normales Körpergewicht achten, um ihre Fuß- und Kniegelenke zu schonen. Manche Patienten scheinen von einer Diät oder Fastenkur vorübergehend zu profitieren.
Prognose & Verlauf
Unbehandelt verläuft die rheumatoide Arthritis sehr unterschiedlich. Sie kann gleichmäßig und innerhalb von Wochen oder Monaten fast alle Gelenke befallen oder jahrelang auf wenige Gelenke beschränkt bleiben und plötzlich schubweise wieder aktiv werden. Bei 10-30% der Patienten verläuft die Erkrankung mild und stabil auch bei nur geringer Dosis von Basismedikamenten, bei 70% dagegen verschlimmert sie sich im Laufe der Jahre immer mehr, wenn sie nicht optimal mit Basismedikamenten behandelt werden.
Wird die rheumatoide Arthritis nicht behandelt, zerstört sie die betroffenen Gelenke so weit, dass sie immer weniger beweglich werden und zuletzt völlig versteifen. Die Patienten leiden unter starken Schmerzen, werden häufig arbeitsunfähig und verlieren viel an Lebensqualität. Patienten mit rheumatoider Arthritis, die nicht nach heutigen Erkenntnissen und Möglichkeiten optimal behandelt werden, weisen eine gegenüber der Normalbevölkerung eine mehr als doppelt so hohe Sterblichkeit auf, ihre durchschnittliche Lebenserwartung ist um 3-13 Jahre geringer. Grund dafür ist, dass neben den Gelenken oft auch andere Organe, wie insbesondere das Herz und die Lunge betroffen sind. Besonders die Schädigung des Herzens und der Blutgefäße ist die Haupttodesursache bei rheumatoider Arthritis.
Mehrere Untersuchungen zeigen jedoch, dass eine moderne Rheumatherapie mit Methotrexat und mit Biologika die erhöhte Sterblichkeit deutlich vermindert und an die normale Sterblichkeit der Bevölkerung angleicht. Da die Zerstörung der Gelenke zu Beginn der Erkrankung am stärksten fortschreitet, kann in dieser Phase eine Behandlung mit krankheitsmodifizierenden Medikamenten den weiteren Verlauf am wirkungsvollsten beeinflussen. Generell gilt: Je früher die rheumatoide Arthritis erkannt und behandelt wird, desto mehr lassen sich dauerhafte Schäden vermeiden. So halbiert sich das Risiko für bleibende Gelenkschäden, wenn eine rheumatoide Arthritis innerhalb von 6 Monaten nach ihrem Ausbruch behandelt wird. Die Chance, die Erkrankung aufzuhalten und beschwerdefrei zu werden, erhöht sich für die Patienten um das 3-Fache.
Obwohl sich die Versorgung von Patienten mit rheumatoider Arthritis in den letzten Jahren deutlich verbessert hat, werden viele Patienten immer noch nicht rechtzeitig angemessen behandelt. Grund hierfür ist, dass die Patienten nicht sofort zum Arzt gehen, wenn sie die ersten Krankheitszeichen bemerken oder die Krankheit nicht erkannt wird und sie erst spät vom Hausarzt zu einem Spezialisten überwiesen werden. Außerdem gibt es in Deutschland nicht genügend Rheumatologen, so dass die Wartezeiten für einen Behandlungstermin in den ambulanten rheumatologischen Einrichtungen nicht selten zu lang sind. Dies trifft leider auch für unser Rheumazentrum zu. Im Verhältnis zum Bedarf sind nach wie vor zu wenig Rheumatologen an unseren beiden Standorten tätig. Bisherige Anträge unseres RHZ auf neue Arztsitze wurden leider vom Zulassungsausschuss negativ beschieden.
Ein etwas besserer Zugang zum Rheumatologen, eine qualitativ hochwertige Versorgung, ist regional bereits über Selektivverträge mit einzelnen Krankenkassen gegeben, an dem auch unser RHZ teilnimmt. Künftig lässt die neue Versorgungsebene ambulante spezialfachärztliche Versorgung (ASV), die seit dem Jahre 2019 möglich ist, durch den Wegfall von Fallzahlbegrenzungen, der erleichterten Anstellung von Assistenten in den Ambulanzen und auch Praxen, eine Verbesserung der Versorgung mit geringeren Wartezeiten erwarten. Auch wir bemühen uns um eine Zulassung zur ASV Rheuma. Wir gehen davon aus, dass sich mit der erfolgten Zulassung und der möglichen Anstellung von Assistenten, die Wartezeiten deutlich reduzieren und die Versorgung verbessern lassen.
Grundsätzlich ergibt sich eine sehr positive Prognose für Patienten mit rheumatoider Arthritis, die mit einer frühzeitigen Basistherapie und den neuen Behandlungsmöglichkeiten (Biologika, JAK-Inhibitoren) zusehends erfolgreicher behandelt werden kann, und bei der ein Krankheitsstillstand ein erreichbares Ziel ist.
Vorsorge & Schutz
Es gibt bislang noch keine Möglichkeit, einer rheumatoiden Arthritis vorzubeugen. Ob Umwelteinflüsse oder die Ernährung, die Entstehung der Erkrankung beeinflussen können, ist ungewiss. Rauchen dagegen begünstigt die Entstehung und verschlechtert den Krankheitsverlauf nachhaltig. Es sollte unbedingt vermieden bzw. eingestellt werden.
Wenn Sie Krankheitszeichen, wie z. B. Gelenkschmerzen, angeschwollene Gelenke und eine Morgensteifigkeit von mehr als einer halben Stunde bemerken, sollten Sie unbedingt einen rheumatologisch erfahrenen Facharzt aufsuchen. Eine frühzeitige Behandlung innerhalb der ersten 3 Monate nach Ausbruch der Erkrankung ist entscheidend für den Verlauf der Erkrankung.